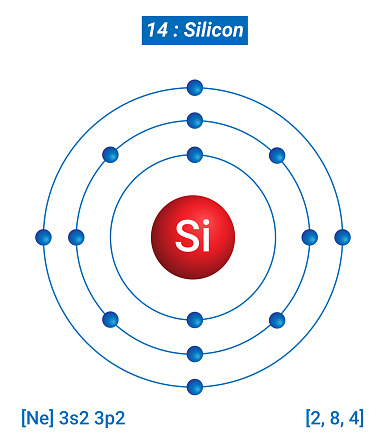
규소, 실리콘, Silicon, 14Si
|
14S
규소/실리콘
硅素, Silicon
|
|||
|
분류
|
상태
|
||
|
원자량
|
28.085
|
밀도
|
2.33 g/cm3
|
|
녹는점
|
1414 °C
|
끓는점
|
3265 °C
|
|
용융열
|
50.21 kJ/mol
|
증발열
|
383 kJ/mol
|
|
원자가
|
4
|
이온화에너지
|
786.5, 1577.1, 3231.6 kJ/mol
|
|
전기음성도
|
1.9
|
전자친화도
|
133.6 kJ/mol
|
|
발견
|
J. J. Berzelius (1824)
|
||
|
CAS 등록번호
|
7440-21-3
|
||
|
|
|||
|
이전 원소
|
알루미늄(Al)
|
다음 원소
|
인(P)
|
|
|
|||
물리적 속성
상태 고체
녹는점 1687 K(1414°C, 2577°F)
끓는점 3538K(3265°C, 5909°F)
밀도(20° C) 2.329085 g/cm3[3]
융합열 50.21kJ/mol
기화열 383 kJ/mol
몰 열용량 19.789 J/(mol·K)
Physical properties
Phase at STP solid
Melting point 1687 K (1414 °C, 2577 °F)
Boiling point 3538 K (3265 °C, 5909 °F)
Density (at 20° C) 2.329085 g/cm3[3]
Heat of fusion 50.21 kJ/mol
Heat of vaporization 383 kJ/mol
Molar heat capacity 19.789 J/(mol·K)

기호 Si. 결정구조는 다이아몬드와 같은 면심입방결정이고 공간군은 Fd3m. 지구 지각의 구성원소 중 산소(46%) 다음으로 높은 약 28%의 질량분율을 차지하며 우주에서는 여덟번째로 많은 원소이기도 하다. 녹는점은 1414°C, 끓는 점은 3265°C로 비교적 높은 편에 속한다.
지구상에서 규소는 보통 4+ 이온에 4배위수를 갖는 규소사면체 혹은 규산염사면체 구조로 존재하며, 규산염 광물은 지표 대부분의 암석을 구성하고 있다. 규소를 특별하게 처리해야하는 연구실이나 관련 업종에 종사하지 않는다면, 보통 이 규산염 구조가 아닌 상태의 규소, 특히 순수한 규소를 만날 일이 없다. 순수한 규소는 금속성 광택이 나는 어두운 색의 고체이며, 단결정 규소는 결정면을 따라서 툭툭 잘 끊어져서 웨이퍼의 형태로 가공되어 많이 쓰인다.
규소는 다양한 방면에서 널리 사용되는데, 가까이는 유리나 반도체, 마모제, 실리콘(silicone) 등에 사용되며, 오늘의 전자기기 발달에 없어서는 안 될 필수 원소이다.
특징
실온에서는 고체상태로 존재한다.
열전도율이 149 W·m-1·K-1로 상당히 높은 편. 그래서 단열목적으로 사용하기에는 적합하지 않다.
전기저항과 온도가 반비례하는 성질을 가지고 있어서 반도체의 성질을 보인다.
물과 기름에 섞이지 않는다.
최후의 항성 핵융합 반응인 규소 연소 과정의 연료다. 주계열 영년시의 질량이 태양 질량의 12배를 넘긴 매우 무거운 항성은 규소를 핵융합 할 수 있는데 규소 원자에 헬륨 원자(알파 입자)가 충돌하여 황, 아르곤, 칼슘, 티타늄, 크롬, 철, 니켈까지 생성한다. 이렇게 생성된 니켈-56으로 핵융합은 이론상 가능하긴 하지만 발열 반응이 미약하여 무지막지한 항성 자체의 질량이 가하는 중력에 저항할 에너지를 충분히 생산하지 못한다. 여기에 규소 핵융합이 일어나는 항성의 핵은 28~35억 켈빈에 달하는 극고온 상태라 원자가 고에너지 감마선을 흡수해 들뜬 상태가 되면서 양성자나 중성자를 배출하는 광붕괴 현상이 일어나 니켈-56의 핵융합을 방해한다. 결국 자신의 중력 붕괴에 버틸 수 없는 항성은 2형 초신성이 되어 밀도가 극히 높은 중심핵 부근만 중성자별로 남기고 구성물질들을 다시 우주로 날려보낸다. 초신성 폭발에 휘말리지 않은 니켈-56은 코발트-56을 거쳐 안정한 철-56으로 붕괴한다.
실온에서는 고체상태로 존재한다.
열전도율이 149 W·m-1·K-1로 상당히 높은 편. 그래서 단열목적으로 사용하기에는 적합하지 않다.
전기저항과 온도가 반비례하는 성질을 가지고 있어서 반도체의 성질을 보인다.
물과 기름에 섞이지 않는다.
최후의 항성 핵융합 반응인 규소 연소 과정의 연료다. 주계열 영년시의 질량이 태양 질량의 12배를 넘긴 매우 무거운 항성은 규소를 핵융합 할 수 있는데 규소 원자에 헬륨 원자(알파 입자)가 충돌하여 황, 아르곤, 칼슘, 티타늄, 크롬, 철, 니켈까지 생성한다. 이렇게 생성된 니켈-56으로 핵융합은 이론상 가능하긴 하지만 발열 반응이 미약하여 무지막지한 항성 자체의 질량이 가하는 중력에 저항할 에너지를 충분히 생산하지 못한다. 여기에 규소 핵융합이 일어나는 항성의 핵은 28~35억 켈빈에 달하는 극고온 상태라 원자가 고에너지 감마선을 흡수해 들뜬 상태가 되면서 양성자나 중성자를 배출하는 광붕괴 현상이 일어나 니켈-56의 핵융합을 방해한다. 결국 자신의 중력 붕괴에 버틸 수 없는 항성은 2형 초신성이 되어 밀도가 극히 높은 중심핵 부근만 중성자별로 남기고 구성물질들을 다시 우주로 날려보낸다. 초신성 폭발에 휘말리지 않은 니켈-56은 코발트-56을 거쳐 안정한 철-56으로 붕괴한다.
Silicon
The symbol Si. The crystal structure is a face-centered cubic crystal like that of diamond, and the space group is Fd3m. It is the eighth largest element in the universe, accounting for about 28% of the mass fraction, which is second only to oxygen (46%) among the components of the Earth's crust. It has a melting point of 1414°C and a boiling point of 3265°C, which are relatively high.
On Earth, silicon usually exists in the form of a silicon tetrahedron or silicate tetrahedron structure with a quadruple number on 4+ ions, and silicate minerals make up most of the rocks on the surface. You don't usually encounter silicon in a state that is not in this silicate structure, especially pure silicon, if you're not in a laboratory or related industry that requires special treatment of silicon. Pure silicon is a dark-colored solid with a metallic luster, and single crystal silicon is widely used as a wafer by being cut off along the crystal plane.
Silicon is widely used in various fields, and is used in glass, semiconductors, abrasion agents, and silicon, and is an essential element in the development of today's electronic devices.
Characteristics
At room temperature, it exists in a solid state.
The thermal conductivity is quite high at 149 W·m-1·K-1. Therefore, it is not suitable for use for insulation purposes.
Since the electrical resistance and temperature are inversely proportional to each other, they show the properties of semiconductors.
It does not mix with water and oil.
It is the fuel for the final stellar fusion reaction, the silicon combustion process. A very heavy star, whose mass exceeds 12 times that of the sun, can fuse silicon. Helium atoms (alpha particles) collide with silicon atoms to produce sulfur, argon, calcium, titanium, chromium, iron, and nickel. Nuclear fusion with nickel-56 is theoretically possible, but the exothermic reaction is weak, so it cannot produce enough energy to resist the gravity applied by the endless mass of the star itself. In addition, the nucleus of a star where silicon nuclear fusion occurs is at a cryogenic state of 28 to 3.5 billion kelvin, and as atoms absorb high-energy gamma rays and become excited, a photo-collapse phenomenon that emits protons or neutrons occurs, hindering the fusion of nickel-56. Eventually, a star that cannot withstand its gravitational collapse becomes a type 2 supernova, leaving only the dense core as a neutron star and releasing its components back into space. Nickel-56, which is not caught up in the supernova explosion, collapses into stable iron-56 through cobalt-56.
On Earth, silicon usually exists in the form of a silicon tetrahedron or silicate tetrahedron structure with a quadruple number on 4+ ions, and silicate minerals make up most of the rocks on the surface. You don't usually encounter silicon in a state that is not in this silicate structure, especially pure silicon, if you're not in a laboratory or related industry that requires special treatment of silicon. Pure silicon is a dark-colored solid with a metallic luster, and single crystal silicon is widely used as a wafer by being cut off along the crystal plane.
Silicon is widely used in various fields, and is used in glass, semiconductors, abrasion agents, and silicon, and is an essential element in the development of today's electronic devices.
Characteristics
At room temperature, it exists in a solid state.
The thermal conductivity is quite high at 149 W·m-1·K-1. Therefore, it is not suitable for use for insulation purposes.
Since the electrical resistance and temperature are inversely proportional to each other, they show the properties of semiconductors.
It does not mix with water and oil.
It is the fuel for the final stellar fusion reaction, the silicon combustion process. A very heavy star, whose mass exceeds 12 times that of the sun, can fuse silicon. Helium atoms (alpha particles) collide with silicon atoms to produce sulfur, argon, calcium, titanium, chromium, iron, and nickel. Nuclear fusion with nickel-56 is theoretically possible, but the exothermic reaction is weak, so it cannot produce enough energy to resist the gravity applied by the endless mass of the star itself. In addition, the nucleus of a star where silicon nuclear fusion occurs is at a cryogenic state of 28 to 3.5 billion kelvin, and as atoms absorb high-energy gamma rays and become excited, a photo-collapse phenomenon that emits protons or neutrons occurs, hindering the fusion of nickel-56. Eventually, a star that cannot withstand its gravitational collapse becomes a type 2 supernova, leaving only the dense core as a neutron star and releasing its components back into space. Nickel-56, which is not caught up in the supernova explosion, collapses into stable iron-56 through cobalt-56.
'과학 > 화학' 카테고리의 다른 글
| 생선 비린내, 생선 비린내가 나는 이 (0) | 2025.01.25 |
|---|---|
| 배관공의 악몽, plumber’s nightmare, 리튬이온배터리 (0) | 2025.01.25 |
| 오줌, 오줌으로 도시 폐수를 정화, Pee, pee to clean up urban wastewater (0) | 2025.01.24 |